
Génie des procédés,
Option bio-procédés
 |
Génie chimique, Génie des procédés, Option bio-procédés |
| Formule de l'E.D.T.A : | 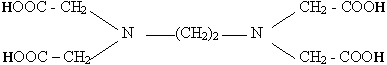 |
| On dose immédiatement avec la solution d'E.D.T.A afin d'éviter la précipitation du carbonate de calcium. |  |
| On dose immédiatement la solution par l'E.D.T.A jusqu'à observer l'équivalence repérée par le virage de l'indicateur coloré du rose au bleu franc. |  |
| Prise d'essai de 25 mL :
CCa2+ et Mg2+ = 0,0101 * 3,17 / 25 CCa2+ et Mg2+ = 2,73.10-3 mol/L |
Prise d'essai de 50 mL :
CCa2+ et Mg2+ = 0,0101 * 6,75 / 50 CCa2+ et Mg2+ = 1,37 . 10-3 mol/L |
| On dose immédiatement la solution par l'E.D.T.A jusqu'à observer l'équivalence repérée par le virage de l'indicateur coloré du rose au bleu franc. |  |