Génie des procédés,
Option bio-procédés
 |
Génie chimique, Génie des procédés, Option bio-procédés |
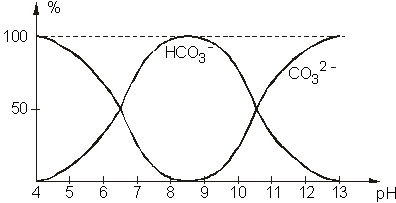
| Une fois les cristaux bien solubilisés, on prélève 20 mL de la solution de borax obtenue à l'aide d'une pipette jaugée de 20 mL à 2 traits de jauge.
On dose l'acide chlorhydrique et on obtient un volume équivalent Véq. |
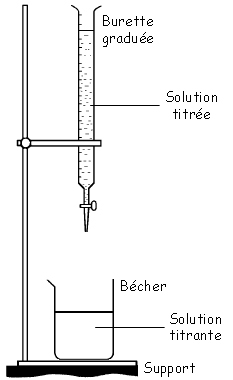 Schéma du dosage |